1989 gruben Paläontolog:innen in der kanadischen Provinz Alberta einen Unterschenkelknochen aus, den sie dem Dinosaurier Centrosaurus apertus zuweisen konnten. Der gehörnte Pflanzenfresser, dem bekannten Triceratops recht ähnlich, hatte vor 77 Millionen Jahren gelebt und wäre an sich keine große Sensation gewesen. Auch eine ungewöhnliche Missbildung erregte erst wenig Aufsehen, die Forscher:innen hielten sie für eine verheilte Fraktur. Erst 2017 kam es zu einer eingehenderen Untersuchung des Fossils – und in der Folge zu einer bemerkenswerten Entdeckung.
Ein interdisziplinäres Team mit Expertise aus so unterschiedlichen Feldern wie Pathologie, Radiologie, orthopädischer Chirurgie und Paläopathologie kam mittels hochauflösender Computertomographie (CT) und anderer moderner Techniken zu dem Schluss, dass es sich bei der Missbildung um eine besonders aggressive Form von Knochenkrebs gehandelt haben muss: ein Osteosarkom. Die entsprechende Studie, die 2020 erschien, beschrieb damit gewissermaßen den ältesten Krebs der Welt.
Immuntherapien für Osteosarkome
Mein Feld ist aber nicht die Paläontologie; ich bin Krebsforscherin. Und ein Osteosarkom ist in meinem Feld leider kein Kuriosum aus der Dinosaurierforschung, sondern eine schwere Erkrankung, die vor allem junge Menschen trifft. Allein in der Europäischen Union mehr als 1100 Kinder und Jugendliche pro Jahr.
Im Gegensatz zu vielen anderen Krebserkrankungen im Kindesalter hat sich die Behandlung des Osteosarkoms in den letzten 40 Jahren weder tiefgreifend verändert noch wesentlich verbessert. Der Krebs wird zunächst mit einer aggressiven Chemotherapie behandelt und anschließend operativ entfernt. Wenn jedoch noch Osteosarkomzellen im Körper zirkulieren, sind diese häufig der Auslöser für die Bildung von Metastasen.
Im Rahmen eines vom Wissenschaftsfonds FWF geförderten Projektes, das von meinem Kollegen Johannes Zuber koordiniert wird, werden Fachleute unterschiedlicher Disziplinen aus Wien und Innsbruck Strategien entwickeln, die langfristig Immuntherapien für Osteosarkome ermöglichen sollen. Auch mein Labor am Institut für Molekulare Pathologie (IMP) im Vienna BioCenter wird daran beteiligt sein.
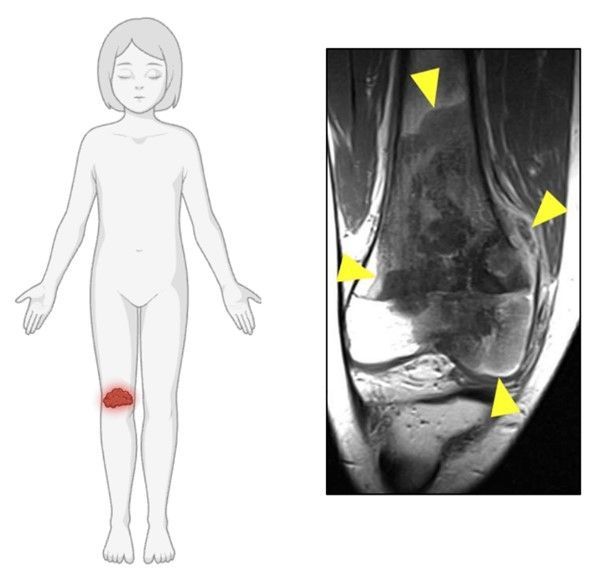
Dafür können wir auf eine Förderung aus dem neuen FWF Förderprogramm "Emerging Fields" zurückgreifen. Das Projekt "DART2OS" – also ein punktgenauer, kleiner Pfeil, der auf das Osteosarkom abzielt – wird eine ungewöhnliche Eigenschaft des Osteosarkoms ausnutzen. Die meisten Krebsarten, die im Kindesalter auftreten, weisen relativ wenige genetische Mutationen auf. Immuntherapien können dann auf bestimmte Proteine abzielen, die in den entsprechenden Krebsarten fast immer vorkommen. Osteosarkome sind im Vergleich zu anderen "Kinderkrebsarten" ungewöhnlich, da einzelne Chromosomen oder Teile von Chromosomen in einem einzigen katastrophalen Ereignis fragmentiert und anschließend zufällig wieder zusammengesetzt werden (Chromothripsis). Das führt dazu, dass jedes Osteosarkom eine einzigartige Identität hat – weshalb Immuntherapien nicht ohne Weiteres auf krebstypische "Standardproteine" abzielen können.
T-Zellen für die Therapie
Dieser Umstand birgt aber auch eine Chance: Chromothripsis führt häufig zur Bildung stark veränderter Proteine (sogenannten Neoantigenen), die in normalen Zellen nicht vorkommen und daher von unserem Immunsystem gut erkannt werden können. Insbesondere T-Zellen können Teile solcher veränderten Proteine auf der Oberfläche von Krebszellen erkennen und sie dann sehr effektiv abtöten. Aufgrund der Chromosomenumverteilung weist jedoch jedes Osteosarkom andere Mutationen und veränderte Proteine auf, sodass zellbasierte Immuntherapien die Entwicklung spezifischer T-Zellen für einzelne Patient:innen erfordern. Dies ist kompliziert, technisch aufwändig, teuer – und wurde bisher noch nie versucht.
Krebszellen (rechts in rot) werden von krebsspezifischen T-Zellen (grün) angegriffen. Das „Scharfmachen“ des Immunsystems gegen bestimmte Art von Krebs ist Grundlage einer Immuntherapie, die bei Osteosarkomen bisher nicht angewandt werden konnte.
Im Rahmen von DART2OS werden wir moderne Technologien nutzen, von denen einige bisher nur in der Grundlagenforschung zur Anwendung gekommen sind. Mithilfe dieser neuen Instrumente wird das Team genetische Mutationen, veränderte Proteine und passende T-Zell-Rezeptoren eingehend charakterisieren und diese Informationen dann nutzen, um patient:innenspezifische T-Zellen für die Therapie zu entwickeln. Wenn alles klappt, dann werden diese T-Zellen Osteosarkomzellen aufspüren und zerstören, und somit die Bildung von Metastasen unterbinden. Kolleginnen und Kollegen aus meinem Labor werden Mechanismen erforschen, die Krebszellen nutzen, um dem Angriff der T-Zellen zu entgehen.
Unser zentrales Ziel ist es, die wissenschaftlichen und logistischen Grundlagen für solche Therapien zu schaffen. Damit würden wir zeigen, dass die Entwicklung personalisierter T-Zell-Therapeutika in einem klinisch verwertbaren Zeitrahmen machbar ist.
Breites Spektrum an Expertise
DART2OS versammelt ein Team von Expert:innen, deren Fachbereiche sich ergänzen: Johannes Zuber, Projektkoordinator und mein Kollege am IMP, bringt seine Expertise in funktioneller Genomik und Krebsgenetik ein. Sabine Taschner-Mandl von der St.-Anna-Kinderkrebsforschung ist Expertin für translationale Forschung und Diagnostik bei Tumorerkrankungen im Kindesalter. Dietmar Rieder von der Universität Innsbruck ist Bioinformatiker mit Erfahrung in der Krebsgenomforschung. Johannes Huppa von der Medizinischen Universität Wien ist Experte für Immunologie und T-Zell-Signalübertragung. Michael Traxlmayr von der Boku ist ein Proteiningenieur und leitet das Christian-Doppler-Labor für "next generation CAR T cells". Mein eigenes Labor ist auf die Erforschung von Therapieresistenzen und Tumorimmunologie spezialisiert.

Gemeinsam bündeln wir also ein breites Spektrum an Expertise und Techniken mit dem klaren Ziel, das Leben junger Osteosarkom-Patient:innen zu verbessern. Wenn unser Ansatz zu neuen, wirksameren Therapien für Osteosarkom-Patient:innen führt, dann könnte er auch als richtungsweisendes Modell für andere Krebsarten dienen. Darüber hinaus werden wir grundlegende Erkenntnisse über das Osteosarkom, T-Zell-Immunologie und jene Mechanismen gewinnen, durch die Tumore dem Immunsystem entkommen. Ich freue mich sehr, dass wir den FWF und die internationalen Begutachter:innen vom Potenzial von DART2OS überzeugen konnten. 77 Millionen Jahre Osteosarkom sind mehr als genug: Jetzt liegt ein wichtiges Stück Forschung vor uns. (Anna Obenauf, 17.4.2024)